

發(fā)布時間:所屬分類:農(nóng)業(yè)論文瀏覽:1次
摘 要: 摘要:本文分別采用乳酸菌與酵母菌發(fā)酵提取仙人掌多糖,并探究仙人掌多糖的抗炎功效。在三個單因素液料比、時間、pH方面探究仙人掌多糖的提取工藝,得到三因素最適組合,乳酸菌發(fā)酵最適提取工藝為發(fā)酵時間7h、液料比25∶1(mL/g)、pH為5,此工藝下多糖得率為0.
摘要:本文分別采用乳酸菌與酵母菌發(fā)酵提取仙人掌多糖,并探究仙人掌多糖的抗炎功效。在三個單因素液料比、時間、pH方面探究仙人掌多糖的提取工藝,得到三因素最適組合,乳酸菌發(fā)酵最適提取工藝為發(fā)酵時間7h、液料比25∶1(mL/g)、pH為5,此工藝下多糖得率為0.26%。黃酒酵母發(fā)酵最適提取工藝為發(fā)酵時間48h、液料比25∶1(mL/g)、pH為3,此工藝下多糖得率為0.53%。應(yīng)用實時熒光定量PCR法檢測仙人掌多糖對IL-6、IL-8炎癥細胞因子相關(guān)基因表達的影響,得知仙人掌多糖通過抑制IL-8的表達,促進IL-6的表達來抑制炎癥的發(fā)生和發(fā)展。
關(guān)鍵詞:仙人掌多糖,微生物提取技術(shù),乳酸菌,酵母菌,抗炎
仙人掌(OpuntiadilleniiHaw)屬仙人掌科仙人掌屬植物,是熱帶及亞熱帶植物,多生長于美洲及墨西哥干旱荒漠或者是半荒漠地區(qū),其中以墨西哥分布最多。我國主要分布在廣西、江西、廣東、福建、海南等地。仙人掌用途廣泛,如食用、做觀賞植物、藥用等。趙學敏所著的《本草綱目拾遺》中記載,仙人掌可作為藥用植物,其具有清熱解毒、安神利尿、行氣活血、消腫止痛、健脾止瀉的功效,可內(nèi)服,亦可外用治療疾病。
仙人掌內(nèi)豐富的仙人掌多糖(Opuntiadilleniipolysaccharide,ODP)是其有諸多功效的主要原因之一。ODP主要從仙人掌的果實和莖里提取而來,極性大分子化合物葡萄糖、鼠李糖和阿拉伯糖是其主要組成物質(zhì)。目前,ODP的抗氧化、抗炎抑菌、免疫、降血糖血脂、抗腫瘤、護肝[1-10]等多種功效都已被證實。除上述的藥理功能,ODP還可防脫發(fā)[11],治療神經(jīng)退行性疾病藥物[12],促進小鼠腹腔巨噬細胞的吞噬功能[13]。如今,仙人掌應(yīng)用愈加廣泛,如:市面上已有仙人掌制的果蔬汁、保健品和面粉制品出售。
傳統(tǒng)的提取多糖的方法如包含水提、堿提、酸提、苯酚提取、微波輔助提取、超聲輔助提取和酶提等方法[14],存在多糖提取率低,純度不高,原料浪費嚴重,且影響對多糖進行結(jié)構(gòu)分析和功效鑒定等問題[15]。本實驗采用微生物法提取多糖,是利用微生物在生長過程中,會利用其他營養(yǎng)物質(zhì)進行生長,但并不利用多糖對植物多糖進行去雜純化,反應(yīng)條件溫和且能耗少。此外,因新鮮仙人掌肥厚的肉質(zhì)莖含有豐富的蛋白質(zhì)、礦物質(zhì)、纖維素和維生素C等,同時含有豐富的SOD、黃酮類及多糖等活性功能成分[16],所以本實驗采用新鮮的仙人掌葉片來進行試驗。本文研究將從以下兩個方面進行:一是用乳酸菌、酵母菌發(fā)酵新鮮仙人掌來探究ODP提取工藝;二是用發(fā)酵得到的多糖液做抗炎實驗,探究ODP的抗炎活性。
1材料與方法
1.1材料與儀器
新鮮仙人掌生長期為3~8個月,云南白藥集團公司;硫酸、苯酚、葡萄糖(均為國產(chǎn)分析純)北京化工廠;乳酸菌北京川秀科技有限公司;酵母菌中國科學院微生物所;Hacat細胞中國檢驗檢疫科學研究院中德化妝品研究所細胞毒理實驗室;水、過濾超純水實驗室制備。
BS2202S型電子天平、A2492型電子天平北京賽多利斯儀器系統(tǒng)有限公司;HR2195攪拌機勻漿機飛利浦有限公司;YZB-蘇(錫)1132-2004低速大容量離心機無錫市瑞江分析儀器有限公司;T6新世紀紫外可見分光光度計北京普析通用儀器有限公司;DSHZ-300恒溫水浴振蕩器江蘇省太倉市實驗設(shè)備廠;電熱恒溫水浴鍋北京長安科學儀器廠;WJ-80A-ⅡCO2培養(yǎng)箱上海圣科;細胞培養(yǎng)瓶、板,凍存管美國Corning/Costar;ABI7300型熒光定量PCR儀美國應(yīng)用生物系統(tǒng)公司;SW-CJ-1D超凈工作臺上海啟前電子科技有限公司;Enduro水平電泳儀美國Labnet公司;Sigma1-14微型離心機德國Sigma;Sigma3-30K高速臺式冷凍離心機德國Sigma;GeneAmpPCRSystem9700PCR儀美國ABI應(yīng)用生物系統(tǒng)公司。
1.2實驗方法
1.2.1ODP提取工藝新鮮仙人掌莖洗凈、去刺、去皮后切碎,用勻漿機勻漿2min,再進行高壓滅菌(120℃,30min),在超凈臺將加入4mL菌液加入100mL仙人掌勻漿液中后用封口膜封口,于空氣搖床(180r/min)培養(yǎng),而后離心(20000r/min,10min)取上清,用旋蒸儀將上清液濃縮至原體積的1/3,再以3倍體積95%乙醇醇沉12h,再一次離心(20000r/min,10min),取沉淀熱水(60℃)溶解得粗多糖液。
1.2.2ODP含量測定標準曲線繪制:參照苯酚硫酸法[17],結(jié)果顯示在0~120μg/mL濃度范圍內(nèi),葡萄糖與A490呈良好的線性關(guān)系,以吸光度對多糖濃度C進行線性回歸,得到回歸方程:y=0.0151x+0.0042(R2=0.9996),y表示吸光度值A(chǔ)490,x表示仙人掌多糖的濃度,μg/mL。
ODP樣品含量測定:取兩只帶塞試管,分別吸取1mL待測液和1mL去離子水,再分別依次添加0.5mL5%苯酚,搖勻后加入2.5mL濃硫酸,蓋上試管蓋,再充分搖勻,靜置5min后,置于水浴鍋中沸水浴1h,測定吸光值A(chǔ)490。并根據(jù)回歸方程計算ODP濃度。
ODP得率(%)=所得的ODP濃度×仙人掌多糖液體積/仙人掌的質(zhì)量×100
1.2.3乳酸菌發(fā)酵法的單因素實驗
1.2.3.1時間對多糖得率的影響將提取的液料比固定為20∶1(mL/g),溫度固定為35℃,pH固定為7,選取5個時間梯度5、6、7、8、9h,作為探究乳酸菌發(fā)酵提取時間的單因素條件,取一定量的多糖溶液,測定該因素下提取得到的多糖含量,從而計算得到多糖得率。
1.2.3.2液料比對多糖得率的影響將提取時間固定為7h,pH固定為7,溫度固定為35℃,選取5個液料比梯度10∶1、15∶1、20∶1、25∶1、30∶1(mL/g),作為探究乳酸菌發(fā)酵提取液料比的單因素條件,取一定量的多糖溶液,測定該因素下提取得到的多糖含量,從而計算得到多糖得率。
1.2.3.3pH對多糖得率的影響將提取的液料比固定為20∶1(mL/g),溫度固定為35℃,時間固定為7h,選取5個pH梯度為3、4、5、6、7,作為探究乳酸菌發(fā)酵提取pH的單因素條件,取一定量的多糖溶液,測定該因素下提取得到的多糖含量,從而計算得到多糖得率。
按以上實驗所得的最佳單因素條件進行實驗,計算最大的仙人掌多糖得率。
1.2.4酵母菌發(fā)酵法的單因素實驗
1.2.4.1時間對多糖得率的影響將提取的液料比固定為20∶1(mL/g),發(fā)酵溫度固定為28℃,pH固定為5.5,選取5個時間梯度24、36、48、60、72h作為探究黃酒酵母發(fā)酵提取時間的單因素條件,取一定量的多糖溶液,測定該因素下提取得到的多糖含量,從而計算得到多糖得率。
1.2.4.2液料比對多糖得率的影響將提取時間固定為48h,pH固定為5.5,溫度固定為28℃,選取5個液料比梯度10∶1、15∶1、20∶1、25∶1、30∶1(mL/g),作為探究黃酒酵母發(fā)酵提取液料比的單因素條件,取一定量的多糖溶液,測定該因素下提取得到的多糖含量,從而計算得到多糖得率。
1.2.4.3pH對多糖得率的影響將提取的液料比固定為25∶1(mL/g),溫度固定為28℃,時間固定為48h,選取5個pH梯度3、4、5、6、7作為探究黃酒酵母發(fā)酵提取pH的單因素條件,取一定量的多糖溶液,測定該因素下提取得到的多糖含量,從而計算得到多糖得率。
1.2.5細胞培養(yǎng)凍存人表皮永生化細胞(Hacat細胞)從-80℃的冰箱中取出后,迅速37℃水浴,輕微震動1~2min使其徹底融化。1000r/min離心10min,棄上清。加1mL細胞培養(yǎng)液(Dulbecco’sModifiedEagle’smedium,DMEM),轉(zhuǎn)移到10cm2培養(yǎng)瓶中,置于37℃5%CO2環(huán)境中培養(yǎng)。細胞生長到90%融合時,動作輕柔地用2mL磷酸鹽緩沖液(pH7.4)洗兩次。加200μL0.25%胰酶后,放入CO2培養(yǎng)箱中消化5min,在觀察確認細胞已從培養(yǎng)瓶壁上脫落后,加2mL的完全培養(yǎng)液終止消化,800r/min離心l0min,去上清液,加入4mL培養(yǎng)液,計數(shù)后,以5×105密度接種于10cm2培養(yǎng)瓶。
1.2.6MTT法測定Hacat細胞毒性實驗選取對數(shù)生長期狀態(tài)良好的Hacat細胞。用0.25%胰蛋白酶將Hacat細胞消化,1500r/min離心1min后重懸于含有10%胎牛血清的DMEM培養(yǎng)基中,計數(shù);用96孔培養(yǎng)板接種細胞,并設(shè)置空白對照,邊緣孔用無菌磷酸鹽緩沖液(PBS)填充,在5%CO2,37℃環(huán)境中培養(yǎng)12h;按照各自終濃度分別加入ODP,細胞對照組是未做處理的組,每組設(shè)3個復(fù)孔,培養(yǎng)44h后,加入5g/L的MTT溶液,繼續(xù)在37℃,5%CO2環(huán)境中培養(yǎng)4h后終止培養(yǎng);吸除孔內(nèi)液體,用PBS洗滌1次,加入DMSO溶解結(jié)晶;M3讀板儀測定各孔吸光度值A(chǔ)570。分別用0.5、1、2、2.5、5mg/mLODP處理Hacat細胞。
Hacat細胞存活率(%)=(測定孔吸光度值-空白對照組吸光度值)/(細胞對照組吸光度值-空白對照組吸光度值)×100
1.2.7ODP處理時間對炎癥細胞因子IL-6、IL-8基因表達的影響將消化后的細胞(消化方法參照1.2.5),以2×106/孔的密度接種6孔板內(nèi),以0.5mg/mL的ODP處理細胞不同時間(0、0.5、1、1.5、2h)。提取細胞總RNA,熒光定量分析處理對炎癥細胞因子在轉(zhuǎn)錄水平表達的影響,內(nèi)參基因定為β-actin。
1.2.8炎癥細胞因子IL-6、IL-8基因在轉(zhuǎn)錄水平表達量的測定
1.2.8.1細胞總RNA提取與檢測總RNA提取及瓊脂糖凝膠電泳檢測RNA,參照文獻[18-19]。
1.2.8.2cDNA第一鏈合成使用TINAGENFastQuantRTKit(WithgDNase)FastQuantcDNA第一鏈合成試劑盒(去基因組)進行cDNA第一條鏈合成反應(yīng)。將得到的cDNA中加1000μLddH2O,稀釋混勻,-20℃保存。
1.2.8.3引物及探針的設(shè)計和合成根據(jù)NCBI發(fā)布的IL-6、IL-8等基因的序列,用PrimerExpress軟件設(shè)計特異性引物,同時設(shè)計管家基因β-actin的特異性引物。基因引物序列見表1。
1.2.8.4實時熒光定量PCR以cDNA為模板,反應(yīng)體系為20μL,其中PrimeScriptRTEnzymeMIX10.4μL,ddH2O7.6μL,正向、反向引物各0.5μL,cDNA模板1μL,使用ABI7300熒光定量PCR儀擴增實驗樣本,擴增條件為95℃2min預(yù)變性,然后按95℃15s,57℃20s,72℃30s,做42個循環(huán),在72℃收集熒光信號。
1.3數(shù)據(jù)處理
實驗中每個處理重復(fù)三次,用SPSS25.0軟件進行數(shù)據(jù)的顯著性分析,應(yīng)用Origin9.0軟件作圖。
2結(jié)果與分析
2.1乳酸菌發(fā)酵提取多糖單因素實驗
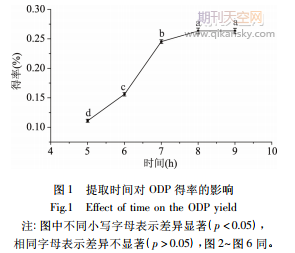
2.1.1時間對得率的影響按照方法
2.1.2液料比對得率的影響按照方法1.2.3.2探究不同液料比對ODP提取的影響,結(jié)果見圖2,隨著液料比的增加,ODP得率顯著性增加(p<0.05),當液料比為20∶1mL/g增加為25∶1mL/g時,得率不顯著增加達到最大值0.23%(p>0.05),隨后得率顯著性下降(p<0.05)。這是因為在一定范圍內(nèi),增加提取液體積可以增加溶劑與提取物質(zhì)的接觸面積,使多糖得以較多溶出,但繼續(xù)增加提取液體積會使多糖達到飽和[20]。因此,乳酸菌發(fā)酵提取的最佳提取液料比為25∶1mL/g。
2.1.3pH對得率的影響按照方法
1.2.3.3探究不同pH對ODP提取的影響,結(jié)果見圖3,隨著pH升高,ODP得率顯著增加(p<0.05),在pH=5時得率達到了最大值0.28%,pH在5~6時得率不顯著降低(p>0.05),超過6之后,得率顯著降低(p<0.05)。這是因為乳酸菌適宜在弱酸情況下生長,隨著pH的降低,菌體生長受到抑制[21]。因此,選取5作為乳酸菌發(fā)酵提取的最佳pH。以溫度為35℃,時間為7h,pH為5,液料比為25∶1mL/g為試驗條件,提取ODP,所得的ODP得率為0.26%。經(jīng)過工藝優(yōu)化的熱水浸提法得到的得率最高為0.12%[22],乳酸菌發(fā)酵的ODP得率比熱水浸提法的得率高出0.14%。
2.2酵母提取多糖的單因素實驗
2.2.1時間對得率的影響按照方法
2.2.2液料比對得率的影響按照方法
1.2.4.2探究不同液料比對ODP提取的影響,結(jié)果見圖5,隨著液料比的增加,ODP得率發(fā)生顯著性變化,當液料比達到20∶1mL/g,ODP出現(xiàn)降低,當液料比達到25∶1mL/g,得率升高到最大為0.48%,隨后得率顯著下降(p<0.05)。這是因為在一定范圍內(nèi),隨著液料比的增大,提取液體積變大,提取的損耗增加,在液料比20∶1mL/g時損耗增大量大于提取率的增大量,當提取液體積繼續(xù)增大時,損耗比提取得率的增加量小,但當達到某一提取液體積時,多糖溶出會達到飽和從而使ODP得率下降。因此,取25∶1mL/g為黃酒酵母發(fā)酵提取最佳液料比。
2.2.3pH對得率的影響
按照方法1.2.4.3探究不同pH對ODP提取的影響,結(jié)果見圖6,在pH=3時ODP得率最高0.53%,隨著pH的增加得率顯著降低(p<0.05)。黃酒酵母適應(yīng)偏酸性環(huán)境,但不適應(yīng)強酸。因此,黃酒酵母發(fā)酵提取最佳pH為3。
經(jīng)過工藝優(yōu)化的熱水浸提法得到的得率最高為0.12%[22],經(jīng)本實驗所得的黃酒酵母發(fā)酵的工藝條件為溫度28℃,時間48h,液料比25∶1mL/g,pH為3,得率能達到0.53%,比熱水浸提法得率到了4倍。
2.3MTT法測定Hacat細胞毒性如圖7所示,以未加任何ODP的細胞作空白對照,當ODP濃度高達2mg/mL時,細胞增殖活力依然超過90%,說明ODP對細胞幾乎無毒性。且當ODP濃度減小,細胞增殖活力反而增加,ODP濃度為0.5mg/mL時,細胞存活率高達109.07%,說明低濃度ODP對HacaT有增殖作用。
2.4ODP處理時間對炎癥細胞因子IL-6、IL-8基因表達的影響
考察時間效應(yīng),用ODP處理Hacat細胞,2h內(nèi)炎癥因子類基因(IL-6、IL-8)表達量產(chǎn)生了不同的變化。
促炎癥因子IL-6是一種在炎癥和免疫反應(yīng)中具有多種功能細胞因子,可以促進炎癥反應(yīng)中花生四烯酸的釋放,刺激T細胞活化和增殖,提高B細胞中免疫球蛋白的生成,并且誘導(dǎo)急性期反應(yīng)蛋白的產(chǎn)生[23]。ODP添加時間對促炎癥因子IL-6表達量的影響如圖8所示,可看出15min內(nèi)基因表達量出現(xiàn)降低,15~30min時間內(nèi)IL-6表達量平緩升高,而在30~90min時間內(nèi),表達量發(fā)生了顯著的提高(p<0.01),此后又緩慢下降,在2h的表達量與60min時的表達量差不多,但是顯著高于初始值(p>0.05)。整體來看,30min后的促進作用是ODP對IL-6基因表達量的主要影響。ODP對IL-6基因表達量的影響作用,可驗證ODP可能是通過促進IL-6基因的表達從而影響花生四烯酸的代謝而起到抗炎作用的。
IL-8在許多炎癥反應(yīng)中具有聚集和激活淋巴細胞、白細胞和血管內(nèi)皮細胞的功能,可因局部產(chǎn)生的IL-8直接作用于表皮細胞,促進慢性炎癥的發(fā)展[24]。ODP添加時間對的其表達量的影響如圖9所示,IL-8基因的表達量在15min內(nèi)迅速下降,顯著低于初始值(p<0.01),并在之后的15min內(nèi)繼續(xù)緩慢下降,在30~90min這段時間內(nèi)在保持顯著小于初始值的范圍內(nèi)緩慢上升(p<0.05),而之后到2h之間,其又緩慢下降。整體來看,在0~15min內(nèi)ODP迅速抑制IL-8的表達,并在2h的時間內(nèi)ODP始終保持抑制IL-8的表達,這是ODP對IL-8基因作用的主要體現(xiàn)。大量的中性粒細胞因IL-8表達的增高而向炎癥區(qū)域聚集,從而釋放炎癥介質(zhì)加重炎癥反應(yīng)。IL-8的表達因受到ODP作用而受到抑制,間接地炎癥的發(fā)生和發(fā)展就受到抑制。
推薦閱讀:食品加工工藝論文文獻
食品從業(yè)人員在晉升職稱時,也會要求發(fā)表論文,最近也有作者咨詢食品加工工藝方向的論文文獻,為此小編檢索了期刊天空網(wǎng)站的范文庫,在這里給大家分享了食品加工工藝論文范文,需要投稿的作者可以作為參考,或者您也可以將您具體的工作專業(yè)與期刊天空的老師溝通,他們會結(jié)合您的實際情況,給分享更合適的論文文獻。
3結(jié)論
在本課題的研究中,采用乳酸菌與黃酒酵母對用微生物法提取多糖進行了初步探索。結(jié)果顯示,同樣直接使用新鮮的仙人掌汁進行提取,采用乳酸菌發(fā)酵最適提取工藝:發(fā)酵時間7h、液料比25∶1(mL/g)、pH為5,此工藝下多糖得率為0.26%。黃酒酵母發(fā)酵最適提取工藝:發(fā)酵時間48h、液料比25∶1(mL/g)、pH為3,此工藝下多糖得率為0.53%,黃酒酵母發(fā)酵所得ODP得率遠遠高于乳酸菌,因此選取黃酒酵母作為發(fā)酵菌種提取ODP會更有優(yōu)勢。本課題也探究了ODP抗炎能力,結(jié)果顯示ODP通過抑制IL-8的表達,促進IL-6的表達來抑制炎癥的發(fā)生和發(fā)展,為研究仙人掌的抗炎效果提供理論依據(jù)。